



DNA的程序化自组装是一种分子自组装的模型系统,通过该模型构建的纳米结构已被广泛地运用于纳米医学、新型材料、分子计算、生物传感以及纳米机器等领域。DNA自组装主要依赖以Watson-Crick作用为主的碱基互补配对作用,或者非Watson-Crick配对(G-四链体、i-motif和三链体等)。拓展DNA自组装的驱动力类型,使之不受限于常规碱基对之间的相互作用,成为该领域研究的热点之一。近日,药学院 中医药学院左华教授、李春梅教授与美国普渡大学毛诚德教授在该研究领域取得了新进展,相关研究成果在线发表于J Am Chem Soc(2023, 145 (36), 19503-19507, DOI: 10.1021/jacs.3c06260)。
研究团队报道了一种驱动DNA-DNA相互作用并自组装的新型策略:以AMP的DNA适配体为研究模型,通过与腺嘌呤作用,即适配体-配体作用驱动DNA瓦片自组装,得到几何结构确定的DNA纳米结构。这种驱动力不依赖传统的Watson-Crick碱基配对作用,为使用适配体进行程序化DNA自组装提供了新思路与潜在应用。
团队首先分析了AMP适配体的序列特征(图1a):黄色方框里面为结合口袋,红色部分为AMP,其中仅有腺嘌呤和脱氧核糖部分插入结合口袋中,磷酸骨架暴露在外,不与适配体作用。根据这些特点,设计了两条能形成双链且包含AMP适配体的DNA链,命名为L-cA(图1b)。两条链的末端都是碱基A,A和其他碱基之间用碱基C分隔,作为柔性的连接部分。由于AMP适配体具有两个腺嘌呤结合位点,L-cA的两个碱基A能够识别结合口袋,通过适配体-配体的作用自发地聚集形成线性多聚体(图1c)。
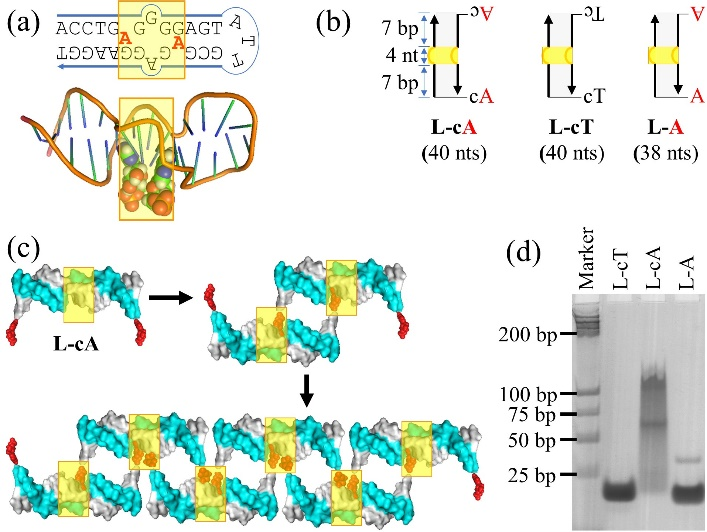
图1. AMP适配体驱动DNA线性结构的自组装。
由于单价L-cA的相互作用较弱,在此基础上,团队进一步引入了二价适配体的理念,设计了二价的DNA模块,即S-cA(图2a)。一分子S-cA中的末端两个碱基A能与另一分子S-cA的结合位点作用,自聚集形成以正方形为主的寡聚结构,并通过原子力显微镜和凝胶电泳进行了表征(图2c, d)。同时,为了将二价的AMP适配体作用力引入到传统的粘性末端介导的DNA自组装中,需要对二价AMP适配体-配体作用力与粘性末端作用力的强度进行对比。为此,设计了由具有不同长度的粘性末端自组装的DNA三角形结构,并通过凝胶电泳将它们的稳定性与S-cA自组装结构的稳定性进行比较(图2c, e)。团队发现,二价的适配体-配体作用力大致与2 bp长度的粘性末端作用力相当。
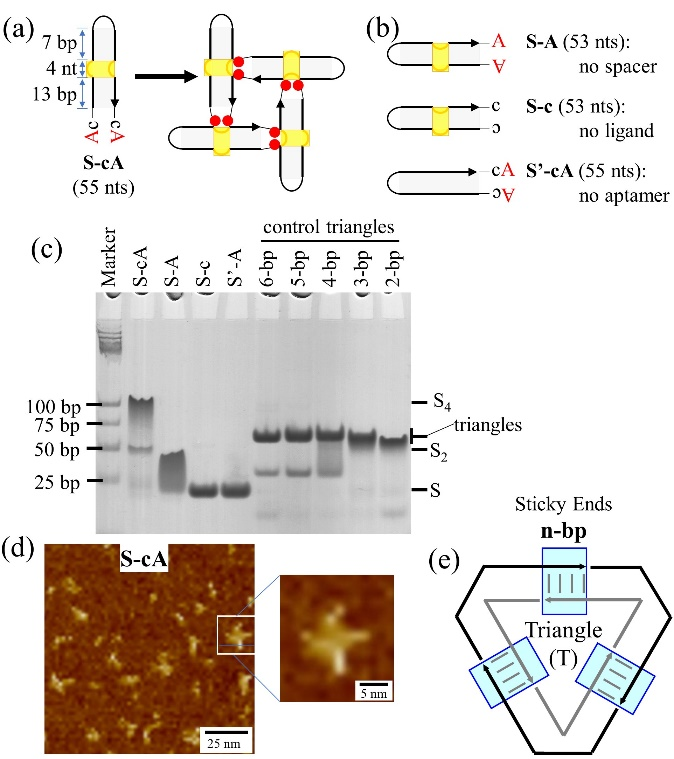
图2. AMP适配体驱动的DNA四边形的自组装。
进一步研究表明,基于AMP适配体-配体结合作用可以编程DNA模块组装成规则的2D阵列结构。团队设计了两个类似的双链DNA模块(2D-a和2D-b)(图3a1, b1),每个双链DNA模块均包含:(1)一个AMP适配体结合口袋;(2)双链的左侧含有两个外延的碱基A;(3)双链的右侧含有4 nt的自互补的粘性末端。2D-a和2D-b均能通过二价适配体-配体作用以类似S-cA的方式组装成正方形结构(图3a2, b2),进而通过粘性末端作用进一步组装形成规则的2D阵列(图3a3, b3)。原子力显微镜成像清晰地展现了2D阵列的形成和规则排列(图3a4, a5, b4, b5)。
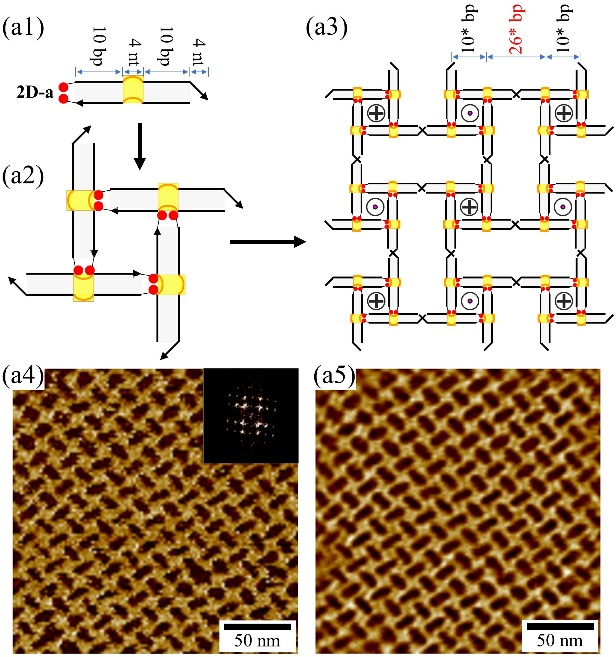
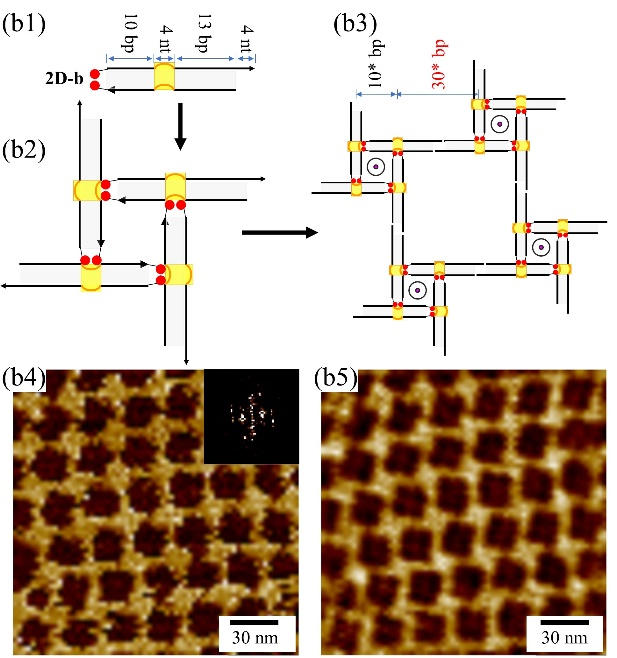
图3. AMP适配体驱动的DNA二维阵列的自组装。
总 结
研究团队开发了一种基于适配体-配体作用力进行DNA程序化自组装的新策略。它的独特之处在于,基于适配体-配体的结合力不同于传统的DNA碱基配对。该策略具备两个有趣且实用的特征:(1)为DNA纳米技术增加了一种新的工具;大量可供选择的适配体极大地扩展了DNA瓦片自组装驱动力的选择范围;(2)提供了一种由各类配体诱导调节DNA自组装的直接方法。由于识别不同分子的适配体可以通过筛选或设计获得,因此,基于适配体-配体作用驱动的DNA自组装理论上可以通过响应各种配体实现,这将为生物传感和工程化的动态、生物仿生系统提供相当有价值的设计思路和潜在应用。
论文信息:
https://pubs.acs.org/doi/abs/10.1021/jacs.3c06260
AMP Aptamer Programs DNA Tile Cohesion without Canonical Base Pairing
J. Am. Chem. Soc., 2023, 145 (36), 19503-19507, DOI: 10.1021/jacs.3c06260.
Copyright © 2021 西南大学科学技术发展研究院 版权所有
请使用IE10及以上版本或火狐浏览器、谷歌浏览器,以获得最佳浏览效果
渝ICP备05006217号
地址:重庆市北碚区天生路2号西南大学南区行政楼一楼 联系电话/传真:023-68251230 邮编:400715

扫码关注「科技西大」